

本文根据前美国专利局审查员、计算机生物医学博士、摩根法律事务所律师李建宏先生 (Matthew Lee) 3月30日做客智慧芽学院线上 webinar 问答环节编辑整理。针对美国药物专利撰写、申请、答复过程中的诸多实务问题,李老师根据美国专利申请特点,从审查员角度出发,结合具体案例与统计数据,做出了详细解答,帮助学员提高美国药物专利申请效率。
1、美国对申请过程中补充实验数据如何考虑?
在专利申请时,如果已经有的实验数据,应当放到申请书当中。有些权利要求 (claim) 例如治疗方法 (method of treatment) 如果没有活体实验 (in vivo) 数据佐证,一般会以缺乏可实施性 (enablement) 为理由被驳回。如果在申请时还没有实验数据,可考虑推迟申请等到有数据之后,或是使用假设例子 (prophetic examples) 来替代实际数据。在审查过程中,如果审查员对可实行性提出质疑,或是要求看数据,这时候可以用说明书(declaration) 的方式来交差。
2、目前我们收到了美国专利局的不满足单一性的 (non-unity restriction notice),需要选择其中一个发明以及一个下位概念 (species)。如果不太同意审查员的认定,需要在回复中提出比较好,还是提分案申请比较好?
如果遇到审查员提出缺乏单一性 (lack of unity) 或是限制要求(restriction requirement),一般建议是不用浪费时间跟审查员抗议这种程序上的小节。因为限制要求 (restriction requirement) 的法律基础是检索负担 (search burden),也就是说审查员认为会造成文件搜索上的负担,这个你是没有办法跟审查员讲的清楚的。你如果跟专利审查员抗争,百分之九十九会失败,结果还是回到原点,虽然一个专利被分成几个分案,会多花一点申请费用,可是因为是审查员主动提出需要切割的,当你审请分案 (divisional) 时,专利局就不会以在先申请作为在先技术 (prior art),以重复专利 (double patent) 为由驳回。相对的,如果是申请人自己主动提出分案(divisional) 申请,那么专利局很可能以重复专利 (double patent) 为理由,驳回申请。
如果审查员认为被切割的几个小组里,有的权利要求 (claim) 是共通的上位权利要求 (generic claim),那么当这个上位权利要求 (generic claim) 被通过的时候,另外没有被选择的发明组都会被加回来。就算是没有上位权利要求 (generic claim),也别忙着马上申请分案。等母案开始审理后,会对审查员的论点比较了解,当母案件发展到审查员认为可以通过的时候再来申请分案,那时审查员对整个案子已经很清楚了清出,子案子也能高很有效率地过关。
而且,该申请为一个母案申请 (parent application) 的加快审查提出的申请,那么分案需要现在提出,还是在母案审查时提出也可以?
在这里我假设 “加快审查” 是指最新的优先审查 (track one) 的机制,而不是传统的“加速审查 (accelerated examination)“的机制。 在这个机制下,子案 (divisional) 也可以要求优先审查 (track one),或是正常的非加速申请。与上相同,我个人建议等母案审请通过时再提分案申请,整体会更高效。
另外,我们需要选择的下位概念必须是来自不同种类的疫苗,如灭活疫苗、产自特定疫苗株的减毒疫苗,以及由疫苗株产生的蛋白质组成的亚单位疫苗 (species is from different kinds of vaccines like inactivated vaccine, attenuated vaccine made from a specific strain, as well as subunit vaccine made from a protein comprised by the strain)。本案的中国审查员并不觉得有问题,但美国审查员认为只能选一种疫苗。因此,如果我们想要保留灭活疫苗和减毒疫苗这两种疫苗,是否需要在再答复限制要求时提出这一点,还是仅仅选择一种,然后为另一种疫苗提起分案申请?后者的话,是要在这次提起申请,还是要等到母发明审查的时候?(vaccines so if we want to keep both of inactivated vaccine, and attenuated vaccine, do we need to argue this in the response to the restriction requirement or we just pick one and file a divisional application for another one? And file it this time or wait until examination of the parent invention?)
有关下位概念的选择 (election of species),应付的策略跟限制要求 (restriction requirement) 是一样的。那些有上位权利要求 (generic claim)的下位概念 (species) 不妨等到母案通过时再做决定。很可能母案子的上位权利要求 (generic claim)被通过了,所有相关的下位概念 (species)都会被加回来。但是如果没有上位权利要求 (generic claim),那么我们知道没有被选的下位概念 (species) 都不可能会被加回来。在这种情况下,如果其他下位概念 (species) 之间的相连性不高,不会引用到相同的文献,那么可以考虑直接申请分案。如果两者之间的关联性比较明显,可以等到母案通过的时候再来申请分案。
3、在美国存在特殊的“潜水艇”专利,特别在生物蛋白药领域有不少这种案例,最近的有依那西普,其专利保护期一直到2028年。今后是否可能还会有已上市药物的“潜水艇”专利冒出?为什么这些专利可以不断的提交分案拖延?申请人在专利申请的时候采用了什么策略?
1995 年专利的有效期从 17 年改 20 年。 这一项改变是针对 “潜水艇” 专利的问题而设。理论上,95 年后申请的专利已经不可能成为 “潜水艇” 专利。你所提到的依那西普 (etanercept) 8,063,182 是 1995 年申请的,一直拖到 1999 年才通过,有效日期从 99 年算起 17 年,所以才会变成到 2028 年还有效。像这一类专利以后出现的机率已经越来越小。以下数据依据年分显示浮出水面的”潜水艇”专利,这些专利都是 95 年申请,到 05 年后才浮出水面。
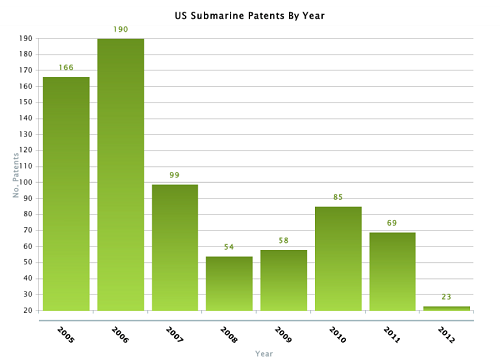
传统的”潜水艇”专利策略已经行不通了。至于生物制剂 (biologics) 跟生物仿制药(biosimilars) 有什么方法可以延续专利权,这是一个目前还在发展中的课题。因为生物制剂 (biologics) 不同于小分子合成药物,食管局方面也没有“橙皮书”(”orange book”) 相关的规定,虽然在2010 年通过的 BPCIA 法规理论上要对生物制剂 (biologics) 专利的应用提出准则,可 BPCIA 有关专利的条文如何诠释目前还在打官司,在这个法规明朗化之前,专利保护策略只能在大原则上抓住要点,基本上与我课堂上所讲的 7 大类专利分析法相同。
另一个问题是:有没有好的途径,可以根据关键词检索美国专利的法律状态数据?比如直接检索状态中有US156或延长专利期限的专利。我了解到的是,欧洲国家的数据库可以直接检索SPC的专利。google和reedtech上也有PAIR的数据下载,但没有好的检索工具。最后谢谢老师的精彩教程!
很不幸,美国专利局在检索工具上的提供不尽完善。因为美国专利局与 google 签约,把最新的专利原始数据文件都定期交给 google,理论上是希望 google 能够给大众提供最好的检索界面。但是 google 在这方面做的一般。
4、请问美国对最佳实施方式 (best mode) 有什么要求?
美国对最佳实施方式 (best mode) 唯一的要求是在专利说明书的本文里有所描述,甚至不需要指出哪一个是最佳实施方式 (best mode)。如果你有一万个类似的有效成分,其中一个特别好,你只要把这个有效成分也列举在内就行,无需特指。
5、据我所知,按AIA,最佳实施方式 (best mode) 似乎无法作为无效专利的理由。请问如果专利申请中不记载最佳实施方式 (best mode) 会有什么不利后果?比如申请了测试了100个化合物,发现其中1个化合物的效果特别好,为了延长专利保护期,他隐藏了这个化合物,后期再申请,这样可以吗?
这要看个案。例如你的发现是 R-COOH 作为某药物有效成分。其中 R = NH2 特别有效。如果整个 R-COOH 都是新的,也就是说你的上位权利要求 (genus claim) 是可以拿到专利的,那么你那个特别有效的成分 (species) 可以在后期独自申请一个专利。你的风险是 R = NH2 可能被专利局认为是显而易见的 (obvious)。再者,如果你想先用 NH2-COOH 并且把它当作是商业机密来保护,等到你觉得市场成熟了再来申请专利,那么一别人很可能会破解你的有效成分,抢先申请了专利,二者当你想申请专利的时候,你之前的商业行为也可能成为在先技术 (prior art)。 我个人的建议是:不需要在这个小节上造成漏洞。
药物市场不是一般的消费市场。它的保护与市场营销除了专利以外还有 FDA 及其他许多的考虑。真正要考虑的事,不是要不要隐瞒最佳实施方式 (best mode) ,而是在专利与商业机密中做一个取舍。
6、如何查美国专利的许可(英文叫license或conveyance,不是专利转让assignment)信息?美国的专利许可通常不备案吗?欧洲(比如英国)如何查询许可信息?
专利许可 (Conveyance) 等于是把专利所有权过户给人家,所以它跟专利转让 (assignment) 是相同,应该是要在专利局登记的。
但是很多公司其实并没有严格遵守,尤其是专利自用而非准备转让授权的公司,因此,美国专利局的专利转让数据库 (assignment database) 可靠程度并不高。不过如果你是善意第三者,你要买一个专利,查了专利局的资料后认为卖方是目前的专利持有人,那么就算卖方之前已经先卖给老王了,但是由于老王没有登记,那么在你买了之后并在三个月内在专利局登记,那老王以后也不能再跑来跟你说专利是他的。
相反的,因为许可 (license) 只是一个专利持有人跟你之间不诉讼的合约,并不是专利权的过户转让行为,美国并没有要求许可 (license) 必须公开登录,也几乎没有公司愿意主动公开登录他们所签的许可 (license)。因此这方面的信息是无法在官方取得的。
7、美国的“橙皮书” orange book中的专利,不同专利的专利权人,是否都应是原研公司(将该药开发上市的公司)?类似地,欧洲SPC补充保护,是否要求申请人须为原研?
“橙皮书” orange book 列出所有经FDA认证药效及安全性通过标准的药物。同时每项药物列举所有保护该药物成分以及使用方法的专利。
这些专利是药物认证申请人在新药申请中在申请书 (NDA or ANDA applicant) 上提出的。并不一定都是原研公司。例如说 A 公司可能是有效成分 x 的原研公司拥有专利 y 来保护 x,B 公司可能是跟 A 公购买了专利或授权了专利然后申请 NDA 的公司。这时 B 公司就会把专利 y 放在申请书上要求 FDA 把它列到“橙皮书”上。
SPC 跟“橙皮书”不是一个概念。SPC 比较像美国的 PTE (patent term extension)。它主要是为了弥补因临床实验等法规所造成专利持有人进入市场的延宥。SPC只能颁给专利持有人,而不是被许可方 (license)。
8、美国仿制药PIV专利挑战,取得180天独占期的条件,是否是得首个/首批获得专利胜诉?
不一定要胜诉,只要是第一个申请专利挑战 (PIV) 的 ANDA,就有资格得到 180 天的独占权。但是如果在法定的情况之下申请者无法完成药物上市,申请者将失去 180 天独占权。这些情况包括如在三十月之内无法完成 FDA 认证,或是在法院宣布最终判决、和解等等。
不考虑因造假等导致FDA审批偏慢这种特殊情形,首个/首批按PIV提起ANDA的公司,是否必将获得180天独占期?与原研达成和解,会影响180天独占期的获得吗?
如上述,最先申请专利挑战 (PIV) 的 ANDA 申请者仅是”有资格”获得 180 天独占权,而非一定会获得。是否能够保有这独占权还得看申请者是否能够很有效迅速的在法定期限内把药物上市。如果与原药厂达成和解,在法庭宣布和解判决书之后 75 日内必须把药品上市。
9、关于药品制备方法及分析方法的可专利性以及如何撰写可获得更好的实际保护(虽然老师也说了方法类专利不易获得保有效保护),可以的话请老师结合实际案例给再介绍下。
这里最主要的障碍是美国专利法 35 USC 101,对于自然法则不给予专利保护,以免造成基本知识的垄断而影响科技的进步。 所以,专利的权利要求 (claim) 撰写要领主要是避免”垄断”自然法则。如能把权利要求 (claim) 跟实际应用绑在一起而不只是描述发明所依据的自然法则,便可突破这一关卡。 以 5,747,282 为例:

联邦巡回法院 (Federal Circuit) 认为,虽然这个检验方法依据 BRCA1基因跟乳腺癌的自然关系,但是它的步骤里要求以细胞培育技术来测试化合物是否为抗乳癌有效成分。这个方法体现了足够的人为步骤,因此突破了 101 的屏障。
事实上这是一个很复杂的问题,基本的原则还得要依据个案逐个分析。如果同学有遇到这类实际案子,还是建议跟美国当地对这方面案例有经验的律师事务所合作。摩根事务所在这方面有很不错的成绩。
药物发明的5个专利保护亮点有哪些?
撰写中避免缺乏“创造性”的4个原则有哪些?
什么是高质量专利?从哪些角度来评估是否高质?
你知道美国专利局对于药物专利的观点吗?
作为特殊商品的药物,在申请专利时应当采取主动模式以抢占先机;药物研究周期长等特点决定了药物专利质量应该是高质量。那么如何做到呢?
3月30日晚,前美国专利局审查员/计算机生物医学博士/摩根法律事务所律师李建宏先生 (Matthew Lee) 做客智慧芽学院线上webinar活动,针对药物在临床前研究的专利申请策略展开了细致讲解。李先生根据药物研发的特点,结合美国专利申请流程,通过两个具体案例,介绍在撰写中如何避免缺乏“创造性”问题。接着从专利的3个考虑点入手,揭秘美国专利局对药物专利的态度,给出药物专利撰写技巧跟建议。从审查员角度出发,内容干货满满,不容错过。
本课程适合药企1-3年经验的知识产权工作者。
(https://x.zhihuiya.com/kecheng/263)
本文由智慧芽根据李建宏先生的回答整理而成,转载请在显著位置注明文章来源和作者姓名。

智慧芽小姐姐
李博士的课程和回答是建立在无数真实案件的积累之上的,很幸运能在初入行的时候就吸收到讲师多年的经验,相信能给工作更多指导。
大萌
“传统的”潜水艇”专利策略已经行不通了。至于生物制剂 (biologics) 跟生物仿制药(biosimilars) 有什么方法可以延续专利权,这是一个目前还在发展中的课题。因为生物制剂 (biologics) 不同于小分子合成药物,食管局方面也没有“橙皮书”(”orange book”) 相关的规定,虽然在2010 年通过的 BPCIA 法规理论上要对生物制剂 (biologics) 专利的应用提出准则,可 BPCIA 有关专利的条文如何诠释目前还在打官司,在这个法规明朗化之前,专利保护策略只能在大原则上抓住要点。”收藏了~李老师为这次课程和问答做了很多准备呢:)