
摘要:研究工具是生物制药产业运营和发展的关键技术,需要利用专利制度予以保护。但素以保护范围宽泛而著称的美国专利法在实践中对研究工具可专利性的认识并不明确统一。这一方面是由于研究工具技术内容与自然法则、自然现象和抽象思想的密切关联,另一方面是由于申请研究工具专利常采用的具有“先占”效应的延展性权利要求所致。因此,对研究工具可专利性的探析需从可专利主题范围、授权实质要件和专利申请说明书诸项要件着手,以期为中国专利法在应对研究工具可专利性问题时提供些许借镜。
关键词:研究工具 可专利主题范围 授权实质要件 专利申请说明书
一、研究工具的定义
从语义角度来看,研究工具一般泛指科研机构和研究人员从事科技研发活动而使用的,有助于技术或产品研究、测试或改进的物质、装置或方法。美国国家卫生院(National Institutes of Health,NIH)在其1999年发布的一篇通告中认为,“细胞株(Cell Line)、单株抗体(Monoclonal Antibodies)、生化试剂(Reagents)、动物模型(Animal Models)、生长因子(Growth Factors)、组合化学或DNA数据库(Combinatorial Chemistry or DNA Libraries)、复制体(Clones)、复制工具(Cloning Tools)、复制方法(Methods)以及实验用装置或机器(Laboratory Equipment and Machines)等皆属研究工具的范畴。”[1]2003年Intergra诉Merck一案也基本沿用了这一定义,将研究工具认定为“研发人员在实验室中使用的工具,包括细胞系、单克隆抗体、试剂、动物模型、生长因子、组合化学和DNA库、克隆和克隆工具、方法实验室设备和机器等”。[2]由此观之,“研究工具”一词虽未在语义上限定具体的适用范围,但在实务中却主要应用于生物科技领域,特指制药和生物技术公司用于发现、提炼或以其他方式设计、识别潜在药物产品及其特性的技术。[3]随后,美国食品药品监督管理局(U.S. Food and Drug Administration, FDA)在一份报告中进一步界定了研究工具,“关键路径(Critical Path)研究的目标是开发新的公开可获取的科技工具,从而使药品开发过程更加高效,更有可能开发出有利于患者的安全产品,具体包括测定方法(Assays)、标准(Standards)、计算机建模技术(Computer Modeling Techniques),生物标记(Biomarkers)以及临床试验终点(Clinical Trial Endpoints)。”[4]总之,任何有助于新型药物产品研究、发展或测试的物质、装置或方法均可以称之为研究工具。
二、研究工具专利化的必要性
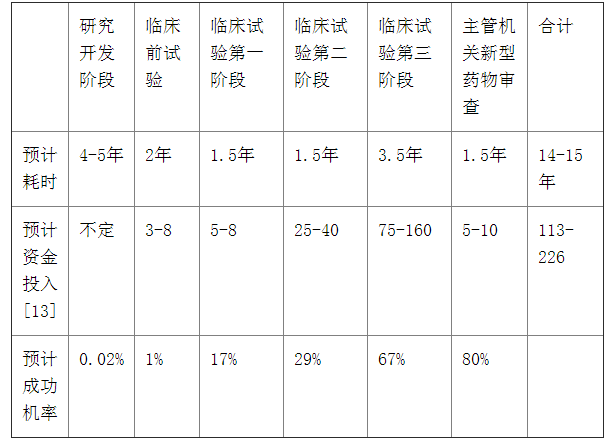
研究工具是伴随着生物科技产业规模的不断扩大以及技术水平的不断提升而大量涌现的。当全球经济仍在严重的经济衰退中挣扎,并试图克服未来经济增长的不确定性时,生物科技产业却获得了显著的发展,逐渐成为囊括发达国家和发展中国家在内的全球竞争新领域。2012年4月,美国联邦政府在其发布的名为“国家生物经济蓝图”报告中称“生物科技产业是一个庞大、增长迅速且产生大量公共效益的世界经济门类”。[5]而生物科技产业的蓬勃发展很大程度上得益于以基因和蛋白质为基础的药物化学[6]在方法论上的重大突破。早期的药物化学研究方法依赖于特定的因果关系,即不断改造某些已知的具有生物活性的化学结构或研发新的具有生物活性的化学结构并以此获取大量的药物化合物。随着信息技术、分子生物学、组合化学等学科的进步,利用精密计算仪器、数据收集、可视化工具以及高通量筛选等新技术处理由基因测序产生的大量不特定信息并最终将其转化和研制成治疗人类疾病药品的研究方法逐渐取代了传统的药物研发机制。[7]在这个过程中,研究工具对药物研发做出了重要贡献。以单克隆抗体技术为例,自1981年首次被批准应用于临床以来,单克隆抗体技术经过不断地改造和革新,现已有14种基于该研究工具的药物被成功批准上市。而且应用单克隆抗体技术的药物靶标范围仍在不断扩大,可有效治愈的疾病种类已达十余种。[8]正如FDA在前述报告中所指出的,“研究工具的价值主要体现在对医药产品研发的关键路径上”,亦即“获取这些新型药物的关键路径需要在药品开发初期使用相应的生物医学研究工具”。[9]值得注意的是,研究工具的作用不仅仅体现在前述获取药物靶标的过程中,在提升识别特定药物医学特征与已验证药物靶标之间关联性的效率方面,研究工具也具有显著的作用。[10]此外,联邦巡回上诉法院法官Randall R. Rader在Integra诉Merck一案中也认为“相较于确认已验证候选药物的安全性和有效性,研究工具在高通量筛选候选药物的过程中将贡献更多的价值。”[11]因此,充分掌握并合理使用研究工具可以为其使用者在新型药品研发市场的竞争中建立明显的竞争优势。但如图1所示,与高额利润相伴而生的是生物科技产业固有的高风险。一方面,新型药物的整个研发过程周期漫长,资金人力投入巨大;另一方面,各研发阶段的研发成功率难以预估,尤其是在研发程序的初期。
表1:新型药物研发各阶段所需时间、资金投入与成功机率[12]
与新型药物的整个研发程序类似,研究工具的研发风险同样很高。鉴此,一旦成功获取对后续成果的研发具有关键路径作用的研究工具,为了合法地维持基于研究工具而建立的竞争优势,维护自身智力成果免受他人侵害,研究工具的发明人通常倾向于利用知识产权制度对其进行保护,主要包括商业秘密保护和专利保护两种模式。若选择以商业秘密的形式对研究工具进行保护,则需要该研究工具的技术内容具有高度复杂性与新颖性,以保证竞争对手难以进行独立开发。然采用这一模式,发明人将在长期的后续研发过程中承担保护其技术内容不为外界所知晓的负担,一旦该研究工具的技术细节不慎泄露或被其竞争对手反向工程成功破解,则权利人将面临研究工具技术价值缩水以及后续研发压力增大的经营风险。因此,许多制药公司选择对研究工具技术内容要求少,适用范围更广的专利保护模式。通过公开研究工具的技术细节以换取在一定期限内排除他人使用的合法垄断权。另外,专利保护模式还可以丰富研究工具发明人的经营研发策略。利用多元化的专利许可协议条款,研究工具专利权人不仅可以整合更易于产出成果的技术力量,提升在研究工具及其后续研发市场的竞争优势,而且还可以通过分享研究工具,降低新型药品研发过程中的高额风险,增加自身经营和研发业务的稳定性。
三、可专利的研究工具主题范围
由于并非所有的研究工具都可以获得专利制度的保护,仅具有专利适格性且满足授予专利实质要件的发明创造能够成为专利制度的保护客体。因此,在明晰了研究工具专利化的必要性之后,我们应进一步思考作为专利的研究工具应该满足的条件。
可专利主题范围又称专利适格性(Patent Eligibility),是判断一项研究工具是否可以被授予专利权的形式要件。美国《专利法》第101条将可专利主题范围界定为“任何新颖且有用的方法、机器、产品或组合以及任何新颖且有用的改良物”。美国联邦最高法院也曾将该法条宽泛地解释为“阳光下的任何人造之物”。[14]由此观之,美国专利法并未直接承认或者排除研究工具的专利适格性,因此一切符合该条规定的研究工具发明均可提出专利申请。但由于部分研究工具的自身特性,是否符合可专利主题范围尚需借鉴典型案例的判决结果,需进一步类比分析,以求厘清研究工具可专利主题范围的边界。
(一)Bilski案与可专利的方法类研究工具主题范围
方法类研究工具通常能够利用某种实验方法(Methodology)达成某项特定功能。例如,在药物研发过程中广泛使用的聚合酶链锁反应(Polymerase Chain Reaction,PCR)即属此类型的研究工具,其主要作用是将特定的DNA片段加以放大和扩增,以供实验人员作进一步的研究。[15]在美国专利实务中,界定方法类研究工具的可专利性主题范围主要依赖机器或转换检测法(Machine -or -Transformation Test),即通过判断一项方法发明是否与特定机器或装置结合在一起或能否将某一特定对象转换成另一不同的状态或事物来检测其是否符合可专利性主题范围的要求。[16]具体来说,该检测法有两种适用情形,一是须与特定机器搭配或结合,二是须转换特定对象的型态。方法类研究工具只须符合其中任意一项条件即具有专利适格性。虽然解决了方法类发明可专利主题范围的问题,但由于Bilski诉Kappos一案的争议专利未与特定机器发生结合,因此CAFC并未就“特定机器”做进一步界定。但根据Diamond诉Diehr案界定“方法“(Process)一词时所确立的“除非有明文规定,否则每一个词汇都应取其普通、符合时代发展的一般含义”解释原则,此处“特定机器”应取其字面含义,解释为“包含固定或移动部件,并能协同执行特定功能的装置或设备”。[17]由此推之,CAFC认为本案中的“转换”是“由特定的实体对象变成另一种形态或事物”而本案争议专利涉及法律义务、法律关系、商业风险或其他抽象概念的运用及转换,这些抽象概念本身不能满足该测试法中“实体对象”的要求。换言之,争议专利描述的是法律权利或选择权的交换,这些权利义务是一种智力活动的产物或抽象概念。即使争议专利包含有一定的物理性步骤,但并不表示这是一个实体对象的改变过程。鉴此,CAFC认为争议专利不符合机器或转换检测法“需要转换特定对象的型态”的适用情形,不属于可专利的主题范围。另外,适用机器或转换检测法对与特定机器的“搭配”或“结合”以及对特定对象型态的“转换”也有一定要求。CAFC援引Gottschalk诉Benson案的观点,指出“对特定机器的“搭配”或“结合”或对特定对象进行的“转换”必须对该方法发明产生有意义的限制(Meaningful Limits)”。[18]另外,“‘附着’与‘转换’不能仅为额外的解决活动(Extra - Solution Activity)”,[19]即仅在该发明所欲解决问题以外作锦上添花式的点缀,并不属于可专利的主题范围。
值得注意的是,虽然方法类发明在形成并产生实用结果的过程中,不可避免地会利用某些自然法则、自然现象和抽象思想,并可能搭配一些特定机器、装置从而使现有技术获得新颖性或显而易见性。既然被专利法纳入可专利主题范围,方法与机器、产品和组合同为独立的专利保护客体,但机器或转换测试法却限制方法发明须与另外三种客体搭配或结合才能具有专利适格性的规定显然有剥夺其专利保护客体独立性之嫌。而美国专利法及立法者并没有将方法发明限制为某种特定形式专利保护客体的意图。因此,联邦最高法院在提审Bilski诉Kappos案时,虽然肯定了机器或转换检测法在判断方法发明是否符合可专利主题范围上的有益作用,但也表示该检测法并不是判断方法发明是否符合可专利主题范围的唯一方法(Sole Test)。[20]与另外三种专利保护客体不同,方法类发明通常并不具有实体外观。所以在判断某一方法发明是否具有专利适格性时,极易产生令人混淆的情况。美国联邦最高法院曾经将“方法”定义为“运作在客体上的一个行为(An Act)或一连续的行为(Series of Acts),能使该客体转换成另外一个状态或事物”.[21]鉴此,方法类研究工具若不是“仅描述人的想法或智力活动”或“独占自然法则、物理现象或抽象概念本身“,而是将这些基本原则与已知的结构或方法进行结合或将某一特定对象转换成另一不同的状态或事物则仍可被专利法纳入可专利主题范围,获得专利适格性。
(二)Myriad案与可专利的产品类研究工具主题范围
与方法类研究工具类似,大部分产品类研究工具往往也与自然法则、自然现象和抽象思想具有密切联系。面对由基因、DNA等生物科技为基础的权利要求或产品类研究工具,美国专利法也曾对于此类发明的专利适格性产生疑惑。在(Diamond诉Chakrabarty案[22]中,争议专利的权利要求是一种可降级分解(Degradation)原油的人造细菌。美国专利商标局在审查过程中认为Chakrabarty的权利要求标的为自然存在的细菌,不属于可专利主题范围。而专利上诉和冲突委员会(Board of Patent Appeal and Interference, BPAI)[23]虽认为该微生物并非自然产物,而是经Chakrabarty研发制成的人工细菌,但其同样否认该标的属于美国专利法的保护客体。本案在上诉至美国联邦最高法院后,联邦最高法院最终认定该标的具有与自然存在细菌明显的差异,属于人造研发的产物,应具有专利适格性。Diamond诉Chakrabarty案不仅确立了“技术的可专利性与该技术是否包含了有生命的物质无关”的观点,从而明确了人工研发微生物的专利适格性,并且将“该有生命的物质是否包含人类干预的结果”确立为判断生物科技专利适格性的一项考量因素,进一步增加了研究工具构成专利法保护客体的现实可能性。
在2013年Association for Molecular Pathology诉Myriad一案中,联邦最高法院再次表示“自然存在的产品不能被授予专利权”。[24]Myriad发现了BRCAI和BRCA2两个人类基因,其突变体会显著增加乳腺癌和卵巢癌发病的个体风险。联邦最高法院认为“不管Myriad投入多少精力和资金识别和分离这两个重要且有用的基因,但它们的DNA序列均是天然存在的Myriad并未创造任何东西。因此,Myriad从其他基因物质中分离基因的行为并不构成发明”。不同于天然存在的DNA序列,联邦最高法院认为由RNA与DNA合成的互补DNA(Complementary Deoxyribonucleic Acid,cDNA)是符合可专利性主题范围的。[25]cDNA在Myriad的专利申请中被描述为“保留DNA天然存在的外显子(Expressed Region)且明显区别于其衍生母体DNA特性的DNA”。[26]联邦最高法院由此总结认为cDNA不是自然产物而具有美国《专利法》第101条所规定的专利适格性。该案再次表明,包含有自然法则、自然现象和抽象思想并不必然影响产品类研究工具的专利适格性。由于所有的发明均在一定程度上体现、使用、反映、基于或应用自然规律、自然现象或抽象概念,过于宽泛地解释这一排除性原则可能破坏专利法。[27]因此,在一个已知的结构或方法中应用自然法则、自然现象和抽象思想并不必然排除专利法的保护。“尽管科学真理或数学表达并不是一个可专利的发明,但一个在科学真理知识帮助下新颖且实用的结构就可能具有专利适格性。”[28]
但是联邦最高法院也在Mayo Collaborative Sevices诉Prometheus Laboratories案中强调“简单地追加常规步骤,以自然法则、自然现象和抽象思想并不能使这些规律、现象和思维获得专利”。[29]在该案中,争议专利涉及使用巯基嘌呤类药物来治疗某些自身免疫性疾病。过低的剂量会令该治疗无效,但剂量过高则会产生一定毒性。然而每一个患者巯基嘌呤代谢不同。该发明是一项确定药物对于患者治疗最佳剂量的方法,主要包含以下几个步骤:首先,对患者用药;其次,确定药物在患者血液中形成的代谢物水平并作为施用巯基嘌呤的依据;最后,检测代谢物与巯基嘌呤的关联性,以确定剂量是否需要增加或减少,并最终至该患者的最佳剂量。联邦最高法院认为该权利要求不能授予专利是因为其仅描述了一种自然规律,即血液中某些代谢物的浓度与巯基嘌呤药物剂量之间的关联性。虽然发现和确定代谢水平、治疗效果和毒性之间关联性的步骤是一项人类活动,但这些无非是医生在诊断和治疗过程中的“例行的常规活动“”因此,将简单重复、不包含智力投入的人类活动与“自然法则、自然现象和抽象思想”进行拼凑并不能满足可专利研究工具主题范围的要求,还需进一步考虑研究工具在整体上是否具有专利法所保护的功能。
四、研究工具专利的实质要件
除了应符合前述的法定专利适格性外,研究工具还应满足一定的实质要件。具体来说,包括新颖性、非显而易见性、实用性等内容。
(一)研究工具的延展性权利要求Reach - Through Claims)
1、延展性权利要求的概念。与一般的权利要求相比,以研究工具为标的的专利申请常会采用一种特殊的权利要求方式。这种特殊性主要表现在权利要求的内容上。具体来说,申请专利的权利要求主要包括申请标的的主要技术内容和技术特征,即要求专利保护的具体范围。由于研究工具特有的“关键路径”属性,以研究工具为标的的权利要求不仅包含有当前发明的技术内容和技术特征,还可能包括基于当前发明而衍生或与之相关的后续发明。但在提交专利申请时该后续发明尚未被实际获取或证实,仍只是一种理论上的可能。这种权利要求通常被称为延展性权利要求。例如,发明人研发了一种新蛋白,该蛋白在高血压患者体内的表达水平远远高于正常人。经研究发现,只要能够降低该蛋白的表达水平或者生物活性就能治疗高血压。换言之,新蛋白可作为高血压治疗中的药物靶标。降低该蛋白的表达水平或者生物活性可作为治疗高血压的一种新途径,并且据此假设只要找到能够降低该蛋白的表达水平或者生物活性的化合物就可以开发治疗高血压的新药。因此,发明人在申请专利时提出权利要求包括“一种蛋白”和“利用该蛋白筛选到的能够降低蛋白表达水平或者生物活性的化合物“”后一项权利要求在提交申请时只是一种基于理论的假设而没有被证实,但利用其研究工具进行后续研发则有可能取得成功。这种权利要求就是典型的延展性权利要求。
延展性权利要求之所以广泛存在于研究工具发明的专利申请过程中,其主要理由是研究工具发明对特定研究领域具有关键路径作用,而研究工具发明的发明人希望基于研究工具的这种特性优先获取专利制度对其尚未实际获得的后续研发成果的认可。由于延展性权利要求具有在发明专利本身的合法边界之外寻求权利的明显意图,因此常被认为是一种不合理的权利要求。若延展性权利要求的内容被专利主管机关审查通过并授予专利权,则其合法垄断效力将会不适当地延伸至其后续的具有专利适格性的技术信息上。这些技术信息并未在该延展性权利要求中被实际获取或证实,一旦被排他性占有则会剥夺其构成一项真正独立发明专利的可能。因此,对研究工具发明提出延展性权利要求可能会阻碍其他研发人员对被该权利要求延及的技术信息的进一步研发。[30]
2、延展性权利要求的分类。有人曾将研究工具形容为“望远镜或显微镜”,而延展性权利要求则类似于将利用研究工具这一“望远镜或显微镜”观测到的一切事物纳入专利申请范围。[31]如表2所示,对研究工具专利申请人而言,利用已知研究工具提供的信息或基于对研究工具功能的使用,往往能够推测、预估并掌握一定的具有理论可能性的后续成果。假设当前的研究工具发明是一个望远镜,研究人员通过“望远镜”看到“镜头”另一端的“行星”以此类推,延展性权利要求就是将当前发明所提供的某种特定技术信息进行延伸、扩展并试图捕获(Capture)其他理论上具有可能性的发明创造。
表2

这种权利要求通常被称为衍生型延展性权利要求。典型的衍生型延展性权利要求通常致力于保护衍生于当前发明的后续成果。例如,一旦发现某个蛋白或基因的序列(研究工具),即可生产相应的单克隆抗体。但延展性权利要求的标的并不都是衍生于研究工具的产品。例如,以一个生物受体蛋白(Biological Receptor Protein)为研究工具。根据该蛋白所提供的可与之进行结合的分子的生物特征可以建立一个识别该分子的筛选方法。发明人进而会利用该方法将可与该受体蛋白结合的分子全部纳入其权利要求范围之中。由此可见,延展性权利要求不仅涉及研究工具本身,它还致力于寻求与研究工具相关联的发明。这种延展性权利要求又被称为关联型延展性权利要求。虽然前述筛选方法的发现得益于生物受体蛋白,但筛选方法的基础还是基于可与该受体蛋白结合分子的生物特性,也即权利要求中可与受体蛋白结合的分子并不是受体蛋白的衍生产品,仅是基于受体蛋白提供的关联性技术信息而可能发现的产品。与衍生型延展性权利要求相比,关联型延展性权利要求中研究工具与后续成果间的“延展性”效力更强、范围更广。因此,关联型延展性权利要求的标的物也更难以在实际中获得或在实验中被证实。
(二)实用性要件(Utility)
实用性是研究工具专利必须满足的实质要件之一。实用性要件要求发明在生产实践活动中能被广泛实施和反复利用。且该功能的实施不得损害公序良俗、伦理道德以及人体健康。
实用性要件对研究工具的可专利性具有一定程度的影响,特别对那些涉及基因序列和其他生物分子的研究工具。这些研究工具可能是为开发具有特定功能的新型材料等后续研发成果提供必要的技术支持或者仅仅是为了增强某些特定功能,但就该研究工具本身来说并不能被直接应用于一线的生产实践。因此,这类发明通常不能通过实用性审查,进而无法获得专利法保护。为了满足实用性要件,提出专利申请的研究工具应无需进一步研究即能够为社会大众提供一些直接可获取、享受的实际功能。2005年CAFC在裁决一项表达序列标签技术(Expressed Sequence Tags,ESTs)的研究工具是否具有实用性时曾表示“研究工具发明的性质不是决定性的,而应判断该发明是否具有‘明确的实质效用’而不是尚待进一步研究以证实的功能。”[32]该裁决进一步解释了作为法定实质要件的实用性。具体来说,实用性是指研究工具发明必须是具体、实在和可信的(Specific、Substantial & Credible)。“具体”和“可信”是指发明必须具有明确的、已经验证的具体用途,排除那些含糊不清或未经证实的潜在用途。涉案的ESTs技术的唯一作用是在研究中分离与试验相关的基因,但鉴于相关基因的功能尚未被确认且该ESTs技术在现实研究中尚未被证实。因此,CAFC裁定以ESTs为标的的权利要求不能被授予专利权。此外,该裁决还明确表示“实用性要件不能在专利申请提交之后才被满足”。若包含该研究工具的权利要求是一项延展性权利要求,则其中还包含有大量的后续研究成果尚未真正获取或尚未被实验证实。即使该研究工具有具体、实在且可信的功能,但实用性要件的判断应基于权利要求内容的整体实用性,这就需要去区分研究工具发明的实质功能和需进一步研究才能建立或证实有效性的功能。因此,这将极大地增加延展性权利要求满足实用性要件的难度。
(三)新颖性要件
一项研究工具发明除了要具有实用性之外,其所主张的权利范围必须是新颖的,即权利要求的标的发明不能属于现有技术,应具有新颖性。新颖性要件是各国专利申请过程中均采用的审查要件,也是最能够体现专利制度价值的基础性要件之一。从保护社会公共利益的角度而言,若不满足新颖性要件而将已为他人所知悉的现有技术申请专利保护,有将公共技术信息私有化之嫌,会对社会公共利益造成极大损害。故已为他人所知悉的现有技术将无法作为专利保护客体。2011年9:月,对美国《专利法》进行全面修订的《美国发明法案》(America Invents Act)不仅放弃了长久以来坚持的先发明制,转而采用了被世界各国所广泛接受的先申请制,而且《美国发明法案》还重新定义了“现有技术”的范围。首先,扩大了地域范围,删除了对现有技术的地域限制。凡世界范围内以专利、公开出版物、公开使用、销售或其他方式为人所知悉的技术均构成现有技术;其次,改变了时间标准,改“发明日”为“有效申请日”。由于有效申请日总是迟于发明日,现有技术的范围也随之扩大了。就审查实务而言,审查研究工具发明的新颖性要件与其他发明专利相同,都必须将该权利要求范围的各项要求逐一与该领域之现有技术进行比较,以确认之间具有实质性差异。
(四)非显而易见性
非显而易见性是为了排除权利要求的标的技术经所属领域的普通研究人员依据一份或多份引证文件就可知的现有技术;或参酌申请时的一般性常识,以转用、置换、改变或组合等方式,运用现有技术完成的显而易见发明。美国专利法中所谓非显而易见性即是我国专利法中规定的创造性,其具体规定见于美国《专利法》第103条。其中第103条(a)项指出,。除不能具有第102条丧失新颖性的情形外,一项技术的技术内容需尚未变成普通技术才能满足非显而易见性要件。”也即若研究工具与现有技术的差异对该技术领域普通技术人员是显而易见的,则不能满足非显而易见性要件。换言之,该研究工具拥有突出的技术特征或明显的优越功效并非该技术领域普通技术人员所能显而易见或直接掌握。
美国联邦最高法院在1966年Craham诉John Deere案[33]中发展出判断发明是否满足非显而易见性要件的适用标准。首先要将该技术与申请日前的现有技术进行对比看是否有区别。其次,判断该技术领域的普通技术人员能否通过现有技术轻易地取得该技术。最后,还可以依据某些辅助性因素来判断其是否有非显而易见性。在随后的Dennison Mfg诉Panduit案中,CAFC阐述并确立了教导—启示—动机测试法(teaching-suggestion-motivation test)”[34]由于该检验标准对非显而易见性的判断具有很强的可操作性,因此被美国法院和USPTO所广泛采纳。但随着产业技术水平的逐渐成熟,过于严格和客观的判断标准增加了生物科技、航天技术等高科技领域内技术获得专利保护的难度。从上世纪80年代末期至90年代初期,美国各级法院和USPTO对于研究工具的非显而易见性审查标准相当严格,不承认大部分的生物科技发明具有非显而易见性。直到2007年,联邦最高法院在KSR诉Telefex案[35]的判决中指出CAFC使用其所发展出的教导—启示—动机测试法太过僵化及公式化,在放弃该方法的同时重新采纳了其在Graham诉John Deere案所发展的判断方法。
对于处于技术链前端、对相关技术领域通常具有关键路径作用的研究工具如何满足非显而易见性要件的要求,美国专利法还设置一些特殊条款。如美国《专利法》第103条(b)项(1)款就规定,若方法类生物科技与其组合物“在同一个专利申请或具有相同有效申请日期的不同专利申请时”、“在完成发明时属于同一人所有或移转至同一受让人时”应视为具有非显而易见性(shall be considered nonobvious)。这一规定迎合了以方法类研究工具为标的的权利要求的客观现实。为了符合专利适格性的要求,方法类研究工具通常需要与特定的机器、产品、组合进行结合,而这些机器、产品和组合的非显而易见性可能并不充分,这种具有拟制效果的条款则能够规避“发明整体上需具有非显而易见性”的要求与方法类研究工具辅助部分难以满足该要件的矛盾。
五、专利申请说明书诸要件与研究工具的可专利性
除了可专利主题范围与授予专利的实质要件,研究工具在专利申请过程中还需满足专利申请说明书的诸项要件才能被专利主管机关授予专利权。美国《专利法》第112条(a)项规定了专利申请说明书“应包括本发明的书面说明以及使用、制造方法或步骤,并以完整、清晰、精简、明确的语言使该发明所属技术领域中具有普通知识的技术人员或最相关的技术人员能同样制造和使用该发明且应说明发明人实现发明的最佳实施方式。”简言之,专利申请说明书应符合书面说明(Written description)、可实施性(Enablement)、最佳实施方式(Best mode)等三项要件。
(一)书面说明要件
University of Rochester诉Searle案[36]是美国专利制度中研究工具适用专利申请说明书诸项要件的标杆性案件。该案始于University of Rochester研究人员实验中识别出PGHS-1和PGHS-2两个关联紧密但功能各异的酶。这两种酶均参与人体内前列腺素的生产,其中PGHS-1在胃肠道中通过产生激素保护胃壁,而PGHS-2则产生负责疼痛和炎症的前列腺素。由于阿司匹林和布洛芬等传统药物会同时抑制这两种酶,所以会同时产生疼痛出现和炎症消退的情况,并且还可能伴随一定的不良副作用,如胃部不适,溃疡出现,胃壁出血等。University of Rochester的研究人员开发出一种鉴定、筛选和测定化合物的测定方法,能够选择性地抑制PGHS--2且不会影响PGHS-1的功能,即在消退炎症的同时不刺激胃壁,不会引起肠胃的相关副作用。基于这一发现,University of Rochester的研究人员先后申请并获得了两项专利。第一项专利(美国专利号:5,837,479,以下简称479号专利)是一种鉴定方法,用于鉴定由哺乳动物前列腺素H合成酶(PGHS-2)催化的抑制前列腺素合成的化合物;第二项专利(美国专利号:6,048,850,以下简称850号专利)共有3项独立权利要求和-项从属权利要求,均要求保护“选择性抑制人体PGHS-2活性的方法”,该方法可用于鉴定、筛选和测定“基于治疗需要而向人体施予一种选择性抑制PGHS-2基因活性的非甾体类化合物”。
书面说明要件建立了一个关键标准能够从合法的权利要求中剔除不合理的研究工具,尤其是不合理的包含研究工具的延展性权利要求。479号专利是一项方法类研究工具发明,用于鉴定选择性抑制PGHS-2活性的化合物。由于该鉴定方法并不涉及尚未出现的后续成果,因此、8:号专利并不是一项延展性权利要求。与此相反,850号专利是一项典型的延展性权利要求,它基于选择性抑制PGHS-2基因活性的非甾体类化合物作为抑制剂,来保障选择性抑制人体中PGHS-2活性方法的实现。但在专利申请说明书中,申请人并未公开任何一种这样的化合物,也没有提供关于如何制备这种化合物的建议,还需要经过后续研究而不断发现。因此,在重新评估&-”号专利的可专利性时,纽约西区法院(U.S.District Court for the Western District ofNew York,WDNY)提出了质疑,认为“当必须在实践中验证的化合物功能以及该化合物的获取方法基本上依赖于不断尝试与试错时,是否说明该专利申请说明书中的书面说明不够恰当?”WDNY先是援引CAFC在Vas-Cath诉Mahurkar一案中的观点并指出“申请专利时必须足够详细地描述要求专利保护的发明的各个要素,使本领域的普通技术人员足以认识到发明人在提交申请时所要求保护的发明”,[37]并最终认定案中的书面说明不符合授予专利权的要求。随后,WDNY还回顾了CAFC在Regents of the University ofCalifornia诉Eli Lily案中的判决意见。[38]在该案中,CAFC肯定了一审法院因为书面说明中缺乏对人类DNA编码胰岛素适当描述而认定该专利申请无效的判决。尽管已有建设性的例子解释如何获取一个cDNA编码的人类胰岛素,但人类基因组序列不是完全公开的。该专利申请仅公开了老鼠胰岛素的DNA序列,这并不足以类推获得人类DNA序列。CAFC还认为,“书面说明要件的目的是保证一个发明者在专利申请时描述其发明,而不是在尚未完成时获得对该发明的排他权利”。WDNY在判决中还援引了CAFC在Fiers诉Revel案[39]中的观点。在该案中,权利要求涉及到DNA序列,但由于专利申请说明书并未公开全部的DNA序列,仅公开了一种获取DNA序列的方法,因而未能满足书面说明要件。CAFC认为对DNA的描述需要“一个精确的定义,诸如通过结构式,化学名称或物理性质等”。基于一个公开的分离序列方法,一个未被描述的DNA序列权利要求更像是在其真正完成之前对未来一种“先占”(Preempt)。最后,WDNY通过援引CAFC在Enzo Biochem诉Gen-Probe一案的判决,认为“书面说明要件要求完全公开披露一项发明足够的细节及相关的识别特性。[40]判断书面说明是否充分并没有明确的标准。虽然《书面说明指南》没有禁止在缺乏发明的实际物理产品时获得专利保护的可能性,但一项权利要求想要满足书面说明要件的要求应通过限制性的词语、结构、图形、图表和公式来描述对权利要求标的发明的实际拥有”。实际拥有”可以通过不同的方式来表现,例如通过化学公式的附图或结构等公开内容表明权利要求的技术内容已经完成。
值得注意的是,虽然WDNY肯定了University of Rochester的研究人员发现选择性PGHS-2“抑制剂的意义,认为“该选择性XWRVM“抑制剂将构成在疼痛和炎症的治疗的一个重要进展”“但WDNY同时也认为University of Rochester的研究人员既没有在实验中真实地分离出该抑制剂,也没有提供“本领域普通技术人员直接制备该化合物的具体方法“”鉴此,法院认为850号专利“没有任何证据来证明,在提交专利申请的时候发明人自身已经知道或掌握了任意一种这样的化合物”。对PGHS-2抑制剂不充分的描述导致WDNY作出了以下结论:“如果发明人尚未实际获得该化合物或仅在理论上知悉该化合物的特点以及获得该化合物的方法,那么权利要求标的就是理论多于实际,该方法也就不能构成一项发明”。例如,一种利用特定化合物破坏癌细胞而保留健康的细胞的治疗癌症方法。若不能实际掌握这种化合物则这种治疗方法就仅仅是一种医学理论知识,以保护该方法为权利要求并不能通过专利审查。[41]而且,利用试错的方法识别和鉴定PGHS-2抑制剂并不足以满足书面说明要件的要求,University of Rochester的研究人员应陈述足够的细节以便本领域普通技术人员理解和认识该权利要求及其包含的发明。然而,850号专利并没有做到这些。在专利申请说明书中关于如何测试化合物有效性的表述并未涉及必然导致该化合物产生的任何程序,而盲目试错的方法也不能“直接产生”(Directly Lead)850号专利所需的化合物。随后,CAFC不仅肯定了WDNY对850号专利不具备美国《专利法》第112号(a)项关于书面说明要件规定的判决,而且还认为“850号专利并未提供任何指导熟练从业人员获取可用于权利要求治疗方法所需化合物的方法,也并未提供的证据表明任何这样的化合物存在于本领域普通技术人员的知识储备中”,不符合书面说明要件的要求。[42]
(二)可实施要件
设置可实施要件一方面可以将抽象的科学理论与实际的科学贡献进行区分,这也是可实施要件最核心的作用,即利用文字描述发明。这不仅仅是表达出科学理论上的希望或预测,更是确保公众能够有效接受到有用信息,并能够真实地制造或使用该发明;另一方面也可以防止发明人权利要求超出申请说明书的范围。根据美国《美国发明法案》第112条(a)项可实施要件,一个本领域的普通技术人员在阅读专利说明书后,结合已知的现有技术必须能够制造和使用本发明权利要求全部范围内的技术,而无需过度实验。WDNY在审理University of Rochester案时曾援引CAFC在PPG Indus诉Guardian Indus案中对“过度试验”的解释,认为“过度试验并不是限制试验的次数,因为一定数量的常规试验是允许的”。[43]CAFC随后又列举了如何鉴别过度试验的几个因素,包括:1.权利要求的范围;2.发明的性质;3.现有技术的情况;4.本领域的相应技术;5.本领域可预期的技术水平;6.发明人提供的方向的数量;7任何已经存在的工作范例;8根据公开披露信息制造或使用发明所需实验的数量。因此,普通技术人员是否为了成功制造并使用该研究工具而进行了过度试验需要视具体情况而仔细权衡。在审理University of Rochester诉Searle案时,WDNY就认定850号专利不符合第112条(a)项规定的可实施要件,理由是“850号专利只能通过试错的方式寻找和发现可以选择性抑制PGHS-2的化合物,这种化合物是850号专利治疗方法必需的抑制剂”。[44]然而850号专利缺乏必要的细节使社会公众理解并实施该发明。法院总结认为,850号专利“在选择特定化合物的过程中并未提供相应的指导或缩小候选范围以便找到所需的化合物,从而导致了过度试验”。因此,850号专利不能满足可实施要件的要求。
(三)最佳实施方式要件
最佳实施方式要件要求发明人取得专利的同时,充分公开且不得隐藏其申请专利时已知的实施该发明的最佳方式。由于一项研究工具可以通过多种实施方式来实现,而可实施性要件只要求本领域普通技术人员制造及使用该发明即可,因此无需提供最佳实施方式;同样地,书面说明要件只要求发明人充分公开研究工具的技术内容和细节,也无需提供最佳实施方式。鉴此,若发明人隐匿向公众提供该研究工具的最佳实施方式,则会影响公开专利技术细节的价值,也会产生对最佳实施方式重复研发的成本消耗,造成科学技术进步的阻碍。因此,美国专利法要求发明人不但要满足书面说明要件和可实施要件,而且还要公开其专利的最佳实施方式以满足最佳实施方式的要求。由此可知,可实施性要件和最佳实施方式要件所要求的“实施”程度应该是有区别的(Separate and District)。[45]可实施性仅要求发明人所请求的发明在说明书内充分公开,并足以使本领域普通技术人员在实践中成功制造并使用即可。然同样的技术内容因不同的实施方式可能会产生截然不同的实施效果,因此最佳实施方式要件不仅要满足可实施性的基本要求,更要让本领域普通技术人员能够以发明人提出申请时已知的最佳方式实施该发明。除了要公开发明的技术细节,还要充分公开最佳的实施方式。相较之下,后者所公开的可实施程度应比前者更高。因此,当说明书满足可实施性要件时,仍可能不符合最佳实施方式要件的要求。
CAFC在Amegen诉Chugai案[46]中提出了一种判断最佳实施方式的标准。首先,应确认发明人在提出专利申请时是否已预期、知悉或拥有其发明的最佳实施方式;其次,若发明人确已预期、知悉或拥有该发明的最佳实施方式,则还需确认专利申请说明书中公开的内容是否足以使本领域普通技术人员能够据此获得其最佳实施方式,也即发明人是否有对公众隐匿该发明最佳实施方式的相关技术信息。这一判断标准同样适用于审查非延展性权利要求的479号专利。值得注意的是,由于没有证据证明发明人已经获得选择性PGHS-2抑制剂,即衍生于研究工具或与研究工具相关联的后续成果尚未被实际获取或未经实验证实,850号专利也就不存在任何最佳实施方式。因此,对于延展性权利要求而言,并不涉及是否满足最佳实施方式要件的要求,仅需考虑其是否符合可实施性要件。
综合前述三项专利申请说明书的要件,美国专利法基本关闭了对延展性权利要求获得专利授权的通道。虽然在实务中,这样的判例会损害研究工具专利发明人利用研究工具“先占”后续成果所带来的潜在利益,但是却避免了“先占”行为对专利制度制度基础的侵蚀,消除了研究工具发明人与其他发明人在后续研究成果上可能出现的确权争议,维护了专利制度的稳定性。
六、研究工具可专利性制度在我国的构建
虽然研究工具在技术内容上的基础性特点使得研究工具与自然法则、自然现象和抽象思想具有十分紧密的联系,但根据前述对美国法例的分析,不难发现美国专利制度对研究工具可专利性的态度也开始转变,从绝对的严格控制逐渐转为有限度地承认。这种转变是符合生物制药产业发展趋势的。生物制药的发展离不开对研究工具的依赖,而“关键路径”技术能否获得专利制度的认可并获得其保护直接关系到生物制药产业的技术进步和竞争格局。根据中国生物产业十二五规划,生物技术药物和其他医药领域“预计将以每年20%以上的速度增长,到2015年总额约为4万亿元人民币。”到2020年,以生物制药产业为代表的生物产业有望成为中国经济的支柱产业之一。同时,生物制药产业也是全球医药产业的重要组成部分,是全球未来经济增长的重要推动力。2010年,生物技术药物约占全球医药市场销售总额的17%,在全球销售额排名前三十的药物中占据三分之一。生物药在各大治疗领域均已获得举足轻重的份额:2010年,生物技术药物约占全球免疫类药物销售总额的79%,肿瘤类药物销售总额的35%。预计从2011年到2016年,全球生物技术药物产业将保持7%的年均增长率,高于全球医药产业其他领域约3%的预期年均增长率。[47]因此,在借镜美国法例的基础上,我国专利法也应积极应对,对当前专利制度进行调整,为我国生物制药产业的发展提供相应的制度支持和政策导向。
首先,及时修订我国专利审查标准,为研究工具的可专利提供必要的法律空间。一方面应适度扩大可专利性主题范围。当前我国专利法尚不承认治疗方法的可专利性,而治疗方法则是研究工具专利的重要组成部分。例如,University of Rochester案中850号专利的权利要求标的是选择性抑制人体PGHS-2活性的方法,若在中国专利制度下则只能被改成相应的制药用途,即“选择性抑制PGHS-2基因产物活性的非甾体类化合物在制备选择性抑制PGHS-2基因产物活性的药物中的应用。”这种权利要求的转化势必会对发明人的权利要求造成不必要的缩限。应适度扩大可专利性主题范围,以适应日益多样化的专利申请需求;另一方面,应调整授予专利的实质要件,从严审查延展性权利要求。从研究工具发明人的角度,延展性权利要求能够最大程度地鼓励其进行技术的研发与探索,但利用专利制度的法定垄断效力将尚未实际获取和未经实验证实的后续成果进行先占不仅阻碍了其他研发人员对后续成果进一步研发,不利于实际掌握后续成果的真实特性,而且破坏了专利制度的理论基础。因此,应调整授予专利的实质要件,对于延展性权利要求实施从严的审查标准。
其次,区别对待具体的研究工具种类,消解公序良俗原则对研究工具可专利性的影响。研究工具仅是一类有助于技术或产品研究、测试或改进的物质、装置或方法的统称,这一概念并不涉及具体研究工具的本质特性。因此,部分研究工具可能涉及人类基因以及其他存在道德争议的技术。立法机关和社会公众对于这类研究工具的可专利性始终存在公序良俗方面的顾虑。虽然美国《专利法》及后续的《美国发明法案》均未就公序良俗原则作出明确规定,但在。1817年Lowell诉Lewis一案中,Story法官曾指出,“发明不应是毫无价值的(frivolous),也不得损害社会福利、良好政策或社会道德。”[48]另外,《与贸易有关的知识产权协议》(Agreement on Trade-Related Aspects of Intellectual Property Rights,TRIPs协议)第27条第2项也规定,“各成员可不授予下述发明专利权,如果在其境内阻止对这些发明的商业性利用对维护公共秩序或道德,包括保护人类、动物或植物的生命或健康或避免严重损害环境是必要的,只要此举并不仅仅因为这种利用为其法律所禁止。”该条款的设置显然不利于涉及人类基因等技术的研究工具获得专利保护。若不对公序良俗原则的适用加以限制,研究机构和研究人员对生物技术领域研究工具的资金投入与研发热情将会被削弱,造成相关领域技术创新的停滞。研究工具是生物制药产业发展到一定阶段所本能产生的一类物质、装置或方法,是伴随着以基因和蛋白质为基础的药物化学在方法论上的重大突破而出现的,其目的在于为技术或产品研究、测试或改进提供一定技术支持。研究工具的出现极大地促进了生物制药科技水平的发展,为提高人类生命质量做出了巨大贡献。或许研究工具发明中的某些技术可能被利用从事违反公共秩序的行为,但这与研究工具发明为社会整体医疗水平的提升以及人类健康所做的贡献相比,给予研究工具发明专利保护仍是值得的。因此,区别对待具体的研究工具种类,承认那些与公序良俗原则不冲突的研究工具的可专利性,而对目前仍涉及道德争议的研究工具暂不承认其可专利性。但为了鼓励这类不具有可专利性的研究工具的持续研发,可以采用多元化的激励方式,如政府补贴、技术招标等形式。
最后,构建实施研究工具专利的相关保障机制。研究工具可专利性的构建主要涉及我国专利审查标准的变更,但事实上,专利技术的实施阶段也会受到研究工具可专利性带来的深远影响。随着知识产权制度的普及与渗透,专利技术对企业竞争力的促进作用日益受到重视,维护企业的市场竞争力成为知识产权制度尤其是专利制度的一项隐含功能,而专利技术也逐渐成为一种竞争工具。然而,许多新涌现的研究工具技术在传统的知识产权理论下可能无法获得相应的保护。因此,相关产业便开始以知识产权的激励作用为由游说并呼吁政府给予研究工具充分的专利保护。但基于前述分析,承认研究工具的可专利性可能导致专利权人在专利的实施阶段剥夺他人通过进一步研究和开发而获得后续成果的机会。专利主管机关担心专利的合法垄断权会在处于技术链条前端的研究工作专利上被进一步放大,从而影响整个生物制药产业的发展。美国联邦最高法院也注意到专利先占问题(Preemption)的严重性。[49]“随着越来越多的人尝试创新、为他们的发明寻求专利保护,专利法面临的一个巨大挑战——在保护发明者和不授予专利权以保留他人使用该发明的机会以创造新技术之间保持平衡。”[50]因此,在专利技术的商品属性以及竞争工具特征日益明显的大背景下,承认研究工具的可专利性会加剧专利权实施的异化。鉴此,为了保障研究工具专利的顺利实施、实现专利权实施的良性回归,在我国专利实务中还应构建和完善相应的保障机制。第一,在研究工具专利的许可协议中推广延展性许可费条款(Reach-Through Royalty)。该条款克服了研究工具专利在订立许可协议时由于缺乏明确的商业化前景而存在的估值难题,同时又能够依据后续研发成果的商业化收益对专利权人的专利许可行为予以合理回报,从而实现了专利许可人与被许可人在使用研究工具专利时的利益平衡。延展性许可费条款的合理应用能够保障研究工具专利的供需双方在公平合理且有效率的前提下实现技术的流转和传播;第二,健全非营利性实施专利制度,保障技术研发的持续性。非营利性实施专利制度又称专利实验使用侵权例外,健全非营利性实施专利制度可促使非营利研究机构在科学研究和试验活动中无须获得专利权人授权,即可基于非营利性目的使用专利权人专利产品或技术。我国当前的非营利性实施专利制度尚不完善,主要表现在利用国家项目资助对非营利性实施他人专利所得研究成果的归属问题未形成较好的解决方案。建立健全的非营利性实施专利制度不仅有助于降低非营利研究机构的研发成本,而且能够鼓励其利用研究工具进行后续研发,成果可由本领域成员共享,共同提升本领域的整体技术水平;第三,还应注意生物制药产业技术研发过程中的信息安全保障。由于现阶段生物制药技术与基因序列等涉及个人隐私、公共安全的信息关联密切,故在确认研究工具的可专利后的实施过程中还应注意避免基因序列所含信息的泄露、包含基因序列的研究工具专利与基因拥有者所有权的冲突以及潜在的基因资源掠夺等问题。
参考文献
[1]NIH, Principles and Guidelines for Recipients of NIH Research Grants and Contracts on Obtaining and Disseminating Biomedical Research Resources:Final Notice, Fed. Reg.,December23, 1999,Vol. 64 72092, available at http://www.ott.nih.gov/pdfs/64FR72090.pdf, last visited on June, 24,2013
[2]Integra LifeSciences I Ltd. v. Merck KGaA, 33I F.3d 860, 872 n 4(Fed. Cir.2003)
[3]See Federal Trade Commission, To Promote Innovation: The Proper Balance of Competition And Patent Law And Policy (2003), p.18
[4]U.S.Food And Drug Administration, Challenge And Opportunity On the Critical Path To New medical Products, available at http://www.fda.gov/downloads/Drugs/ScienceResearch/ResearchAreas/ucm079290.pdf,last visited on June,26,2013
[5]Obama Administration, National Bioeconomy Blueprint, April 2012,p. 1,available at http://www.whitehouse.gove/sites/default/files/microsites/ostp/national_bioeconomy_blueprint_april_2012.pdf, last visited on June, 26,2013
[6]药物化学(Pharmaceutical Chemistry)结合了有机化学、生物化学、药理学、生药学、分子生物学、统计学及物理化学等学科的知识,以设计、合成、开发新型药物以及探究药品作用机理为主要研究内容。
[7]See generally Jeffrey Hanke, Genomics and New Technologies as Catalysts for Change in the Drug Discovery Paradigm, 28J.L.Med.&Ethics 15(2000)
[8]参见李其翔、张红:《新药药物靶标开发技术》,高等教育出版社2007年版,第3页
[9]同注[4]
[10]See John P.Walsh, Ashish Arora & Wesley M. Cohen,Effects of Research Tool Patents and Licensing on Biomedical Innovation, in Patents In The Knowledge - Based Economy, 285Wesley M. Cohen & Stephen A. Merrill eds. 2003
[11]参见前注[2]
[12]参见何志煌:《生技产业的竞争与价值》,载《生物产业》2004年第1期
[13]本项单位为:百万美元。
[14]Case Diamond v. Chakrabarty,447U.S.303, 309(1980).
[15]See Natalic M. Derzko, In Search of a Compromised Solution to the Problem Arising from Patenting Biomedical Research Tools, Santa Clara Computer and High Technology Law Journal, January 2004, p.348
[16]Case Bliski v. Kappos ,130 S.ct. 3218(2010)
[17]Case Diamond v. Diehr, 450U.S.175(1981).
[18]Case Gottschalk v. Benson, 409 U.S.63(1972)
[19]Case Parker v. Flook, 437 U.S. 584(1978)
[20]Case Bliski v. Kappos ,130 S.ct. 3218(2010)
[21]Case In re Nuijten, 500 F. 3d 1346(Fed. Cir. 2007)
[22]Case Diamond v. Chakrabarty,447U.S.303, 309(1980).
[23]即专利审判与上诉委员会(Patent Trial and Appeal Board, PTAB)的前身
[24]Case Association for Molecular Pathology v. Myriad Genetics, 133 S.Ct.2107,211I(2013)
[25]RNA即核糖核酸(Ribonucleic acid),DNA即脱氧核糖核酸(Deoxyribonucleic acid),两者在一定引导物的作用下可以结合构成互补DNA,也即互补脱氧核糖核酸.
[26]参见前注[24]
[27]Case Mayo Collaborative Services v. Prometheus Laboratories, Inc.,132 S.Ct. 1289,1293(2012), at 94
[28]Case Mackay Radio & Tel. Co. V. Radio Corp. Of Am., 306 U.S.86(1939)
[29]参见前注[27]
[30]Michael A. Heller and Rebecca S. Eisenberg, Can Patents Deter Innovation? The Anticommons in Biomedical Research, Science, Vol. 280(1998)
[31]Case Synaptic Pharmaceutical Corporation v. Astra Alktiebolag, (1998)43 IPR 461
[32]Case In re Dane K. Fisher and Raghunath v. Lalgudi, 421 F.3d1365(Fed.Cir. 2005)
[33]Graham v. John Deere Co. Of Kansas City, 383U.S.I(1966)
[34]Case Dennison Mfg. Co. V. Panduit Corp., 475 U.S.809(1986).该方法主要根据是否满足!现有多份技术文献能够给出明确的教导和启示,并使该领域的普通技术人员产生动机将它们结合并获得该新技术"的条件来判断权利要求中所请求保护的技术是否能够被认定具有显而易见性。因此,该测试法的可操作性很强,但从另一方面来说,该测试法过于严格和僵化。
[35]Case KSR International Co. V. Telefex Inc.,550 U.S.398(2007)
[36]Case University of Rochester v. G.D.Seaele & Co.,249F. Supp, 2d 216, 232(2003),affd, 358 F.3d 916(Fed. Cir. 2004).
[37]Case Vas-Cath Inc. V. Mahurkar, 935 F.2d 1555(Fed.Cir.1991)
[38]Case Regents of the University of California v. Eli Lily Co. 119 F. 3d 1559(Fed Cir. 1997)
[39]Case Fiers v. Revel, 984F.2d 1164(Fed. Cir. 1993)
[40]在该案的判决中,CAFC采纳了《关于专利法第112条(1)项的专利申请审查指南》(又称《书面说明指南》)中的观点,该指南由USPTO发布,虽不具有法定强制力,但可为法院判决提供一定程度的司法指导.Case Enzo Biochem,Inc. V. Gen-Probe Inc, 296 F.3d 1316(Fed. Cir. 2002)
[41]Case University of Rochester v. G.D.Seaele & Co.,249F. Supp, 2d 216, 232(2003).
[42]Case University of Rochester v. G.D.Seaele & Co.,Inc.,358 F.3d 916(Fed.Cir.2004).
[43]Case PPG Indus.,Inc. V. Guardian Indus. Corp.,75 F.3d 1558, 1564(Fed. Cir.1996).
[44]参见前注[41]
[45]Case Bayer AG v. Schein Pharm., Inc. 301 F.3d 1306(Fed. Cir. 2002)
[46]Case Amgen Inc v. Chugai Pharmaceutical Co.,927 F.2d 1200(1991)
[47]中国外商投资企业协会药品研制和开发行业委员会等,《在中国打造世界领先的创新型生物技术药物产业》,访问地址:http://www.bcg.com.cn/cn/newsandpublications/publications/reports/report20130130001.html,访问时间:2014年5月8日。
[48]Case Lowell v. Lewis 15 F. Cas.1019(1817).
[49]Case Mayo Collaborative Sevice v. Prometheus Laboratories, Inc.,132 S.Ct.1289,1293(2012), at 1301-1302.
[50]Case Bliski v. Kappos ,130 S.Ct. at3218.
作者:周围
来源:中国知识产权研究网
